Содержание
ОСОБЕННОСТИ ВСАСЫВАНИЯ ОКИСИ ТРИТИЯ ЧЕРЕЗ ИНТАКТНУЮ ПОВРЕЖДЕННУЮ КОЖУ Текст научной статьи по специальности «Ветеринарные науки»
Для повышения эффекта врабатывания и поддержания устойчивой работоспособности в дни теоретических занятий и учебной практики целесообразно ввести гимнастику до начала деятельности подростков и физкультурные паузы во второй половине учебного дня. Перемены между уроками продолжительностью 5 мин. можно ввести лишь при сокращении урока до 35 мин. При этом через каждые 70 мин. необходимы 10-минутные перемены. Такая экспериментальная схема учебного режима, принятая в вечерних сменных школах при условии повышенных нагрузок, может быть рекомендована и для учащихся, сочетающих общее и профессиональное образование. При обычных уроках длительностью 45 мин. учебный день должен ограничиваться 6 уроками.
Поступила 7/VI 1968 г
HYGIENIC SUBSTANTIATION OF THE TEACHING ROUTINE AT OCCUPATIONAL TRAINING SCHOOLS WITH THE SECONDARY
EDUCATION COURSE
L. G. Grueva
G. Grueva
Investigation of a number of physiological functions and that of certain indices of the state of health and the morbidity of adolescents, studying at occupational training schools with an extended curriculum, proved the conjuction of secondary and occupational education in one sckool to be quite possible. However, it requirel the improvement of the general teaching routine and strict fulfillment of hygienic requirements.
УДК 612.791.4:546.212.023
ОСОБЕННОСТИ ВСАСЫВАНИЯ ОКИСИ ТРИТИЯ ЧЕРЕЗ ИНТАКТНУЮ ПОВРЕЖДЕННУЮ КОЖУ
В. В. Хоробрых
Вопрос о всасывании окиси трития через кожные покровы исследован недостаточно, а полученные экспериментальные результаты противоречивы.
Мы ставили своей целью изучить особенности всасывания окиси трития через интактную и механически поврежденную кожу. Это важно как в практическом отношении, поскольку люди в процессе профессиональной деятельности могут иметь загрязнения кожных покровов радиоактивными изотопами в сочетании с травмой, так и в теоретическом отношении — для выяснения барьерной роли переходных слоев эпидермиса.
Опыт был поставлен на 104 белых беспородных крысах-самках весом 214±0,43 г. Изучали всасывание окиси трития через интактную и поврежденную кожу хвоста. Все животные были разделены на 3 группы. В 1-й группе (24 особи) исследовали всасывание изотопа через интактную кожу, во 2-й (26 особей) — при 10-разовой травме и в 3-й (24 особи) — при 20-разовом повреждении эпидермиса. Слущивание слоев эпидермиса производили по методике, описанной Фредрикссоном. Для удаления чешуек рогового слоя использовали полоски лейкопластыря шириной 0,75 см однократно.
Для того чтобы определить степень разрушения эпидермиса, проводили морфологическое исследование кожи хвоста у 3 крыс из каждой группы. Препараты кожи фиксировали в 10% растворе формалина, а затем обрабатывали их по общеизвестной морфологической методике. При микроскопическом исследовании препаратов кожи выявили на отдельных участках интактной и поврежденной кожи явления паракератоза, что, по-видимому, связано с легкой травматизацией рогового слоя кожи хвоста. У крыс с интактной кожей роговой слой толстый и клетки его плотно прилегают
У крыс с интактной кожей роговой слой толстый и клетки его плотно прилегают
друг к другу. При 10-кратном травмировании кожи роговой слой сохранен, но его толщина уменьшена в 2—3 раза, а роговые чешуйки раздвинуты. При 20-кратном травмировании кожи на поверхности хвоста появляются мелкие капельки световой жидкости, видные невооруженным глазом, а также единичные точечные кровоизлияния. Поверхность кожи становится розовой и блестящей. Микроскопическое исследование в этом случае показало, что роговой слой удален полностью или сохранен в виде рваной тонкой полоски клеток, а роговые чешуйки на некоторых участках раздвинуты выпотом; отмечается также очаговое повреждение зернистого и росткового слоев эпидермиса. В дерме кожи патоморфологических изменений не обнаружено.
Животным, фиксированным в пеналах для взятия крови, на среднюю часть хвоста (после предварительного осмотра его под лупой, чтобы исключить повреждение рогового слоя) приклеивали клеем № 88 специально изготовленный нами колпачок из органического стекла, имеющего окно площадью 2 см2, куда наносили 0,1 мл раствора изотопа общей активностью 2,03 мкюри на крысу. Для предупреждения испарения окиси тоития с поверхности кожи окно колпачка заклеивали липкой полиэтиленовой пленкой. Возможность поступления изотопа через органы дыхания и желудочно-кишечный тракт исключалась в процессе затравки. Время контакта окиси трития с кожей крыс варьировало от 30 мин. до 12 часов. После окончания аппликации с окисью трития хвост отсекали, забивали по 4—6 крыс на каждый срок, причем одна из них была контрольной. У забитых живитных брали органы, из которых выделяли воду. Активность в пробах воды из органов и тканей измеряли на установке типа Б при помощи счетчика с использованием жидких сцинтилля-торов. При расчете общей активности окиси трития во всей воде допускали, что в организме взрослого животного содержится 70% ее (Widdowson и Оккегзоп).
Для предупреждения испарения окиси тоития с поверхности кожи окно колпачка заклеивали липкой полиэтиленовой пленкой. Возможность поступления изотопа через органы дыхания и желудочно-кишечный тракт исключалась в процессе затравки. Время контакта окиси трития с кожей крыс варьировало от 30 мин. до 12 часов. После окончания аппликации с окисью трития хвост отсекали, забивали по 4—6 крыс на каждый срок, причем одна из них была контрольной. У забитых живитных брали органы, из которых выделяли воду. Активность в пробах воды из органов и тканей измеряли на установке типа Б при помощи счетчика с использованием жидких сцинтилля-торов. При расчете общей активности окиси трития во всей воде допускали, что в организме взрослого животного содержится 70% ее (Widdowson и Оккегзоп).
В специальном эксперименте на 21 крысе через 6 часов после внутривенного введения окиси трития в организме их обнаружено 95,7+11,09% его, а после 12 часов — 93,4+4,73%.
Таким образом, за 12 часов крыса выделяет с парами выдыхаемого воздуха и экскрементами около 6,6% изотопа. Эти данные свидетельствуют о том, что выведением окиси трития из организма за время эксперимента можно пренебречь. Радиоактивность, обнаруженная в воде органов и тканей после нанесения изотопа, практически полностью соответствует количеству окиси трития, поступившему через кожу.
Эти данные свидетельствуют о том, что выведением окиси трития из организма за время эксперимента можно пренебречь. Радиоактивность, обнаруженная в воде органов и тканей после нанесения изотопа, практически полностью соответствует количеству окиси трития, поступившему через кожу.
Результаты экспериментов показали, что окись трития, поступившая через кожу, равномерно распределяется в воде органов и тканей. С увеличением срока контакта изотопа с кожей возрастает содержание активности в воде организма. Общая активность в водной фазе крыс при различной продолжительности кожной аппликации окиси трития через интактную кожу составила: за 30 мин. 0,206±0,086%, за 1 час. 0,30±0,04%, за 2 часа 0,78±0,08%, за 4 часа 5,4±1,72%, за 6 часов 8,59+0,55% и за 12 часов 16,28±0,61%. При 10-кратном повреждении рогового слоя она равнялась: за 30 мин. 1,71 ±0,124%, за 1 час 5,36±0,81%, за 2 часа 36,37±2,86%, за 4 часа 43,02±7,22%, за 6 часов 54,96±8,98%, за 12 часов 89,75±5,20%, при 20-разовом повреждении кожи концентрация окиси трития соответственно составляла 40,96±6,72, 53,28+9,05, 86,27±4,90, 84,97+0,91, 80,28±8,72 и 85,29±1,38% нанесенного количества изотопа.
При разрушении рогового слоя общая активность в водной фазе организма крыс и скорость всасывания окиси трития через кожу резко возрастают (см. рисунок). Кривая, характеризующая динамику поступления изотопа через интактную кожу, состоит из медленно и быстро нарастающих компонент. При 10-кратной травме кожи медленная часть компоненты укорочена в 2 раза, а при 20-разовом повреждении она отсутствует вовсе. Медленно нарастающая часть кривой, по-видимому, характеризует время, необходимое для преодоления рогового слоя, который служит барьером для окиси трития и других соединений. Это подтверждается тем, что с уменьшением толщины рогового слоя (10-кратная травма) изотоп преодолевает барьер за более короткий срок.
Можно прийти к заключению, что при неповрежденном роговом слое всасывание окиси трития через кожу происходит медленно. Кинетика резорбции изотопа состоит из 2 фаз — медленной и быстрой. Очевидно, для
прохождения окиси трития через роговой слой кожи необходимо время, в течение которого изотоп в основном ‘накапливается в poro; уйках
и только в небольшом количестве поступает в крозь. После того как роговые чешуйки эпидермиса гидрируются, изотоп начинает всасываться с большей скоростью. Уменьшение рогового слоя приводит к сокращению первой фазы. При полном разрушении рогового слоя кожи окись трития начинает поступать в организм в большом количестве и первая (медленная) фаза исчезает. Двухфазную кинетику всасывания водных растворов брома-82, натрия -24 и ка-лия-42 через кожу животных и человека отмечает Treglar. Проникновение изотопов в кровь в течение 100—200 мин. незначительно, а затем концентрация их в ней резко возрастает. При разрушении верхних слоев эпидермиса медленная фаза резорбции веществ через кожные покровы исчезает.
После того как роговые чешуйки эпидермиса гидрируются, изотоп начинает всасываться с большей скоростью. Уменьшение рогового слоя приводит к сокращению первой фазы. При полном разрушении рогового слоя кожи окись трития начинает поступать в организм в большом количестве и первая (медленная) фаза исчезает. Двухфазную кинетику всасывания водных растворов брома-82, натрия -24 и ка-лия-42 через кожу животных и человека отмечает Treglar. Проникновение изотопов в кровь в течение 100—200 мин. незначительно, а затем концентрация их в ней резко возрастает. При разрушении верхних слоев эпидермиса медленная фаза резорбции веществ через кожные покровы исчезает.
Тем не менее единого мнения о расположении барьера, препятствующего проникновению веществ через кожу, не существует. Многими авторами (Burr; Winsor и Burch; Blank) установлено, что проникновению воды через кожу препятствует роговой слой эпидермиса. Другими экспериментаторами (И. А. Ойвин; Roth-man) роговой слой не рассматривается в качестве барьера, так как представляет собой грубую сеть роговых пластинок, через которые могут легко проникать вещества. Эти авторы включают в понятие барьера промежуточные слои кожи, расположенные между ороговевшими и неороговевшими клетками эпидермиса: зернистый и блестящий слои и ин-фрабазальную часть рогового слоя. Для оценки максимальной скорости всасывания изотопа через кожу мы использовали формулу:
Эти авторы включают в понятие барьера промежуточные слои кожи, расположенные между ороговевшими и неороговевшими клетками эпидермиса: зернистый и блестящий слои и ин-фрабазальную часть рогового слоя. Для оценки максимальной скорости всасывания изотопа через кожу мы использовали формулу:
Кинетика накопления окиси трития в водной фазе организма крыс при нанесении на интактную, 10 и 20-кратно поврежденную кожу.
Р =
(Cu-Cti). 100 c0-t-s
где Р — максимальная скорость всасывания изотопа через кожу; Си — количество радиоактивности в организме через часов после аппликации, когда начался максимальный подъем кривой; С1г — количество радиоактивности в организме через /2 часов после аппликации, когда закончился максимальный подъем кривой; С0 — количество радиоактивности, нанесенное на кожу; / — время, за которое происходит всасывание изотопа; 5 — площадь аппликации изотопа на коже.
Максимальная скорость всасывания окиси трития через неповрежденную кожу составляла 1,2% см2¡час и соответствовала 2—4 часам аппликации, при 10-кратном травмировании рогового слоя — 15,5% см*!час и соответствовала 1—2 часам, а при 20-разовой травме — 40,9 % см-[час и протекала в первые полчаса затравки.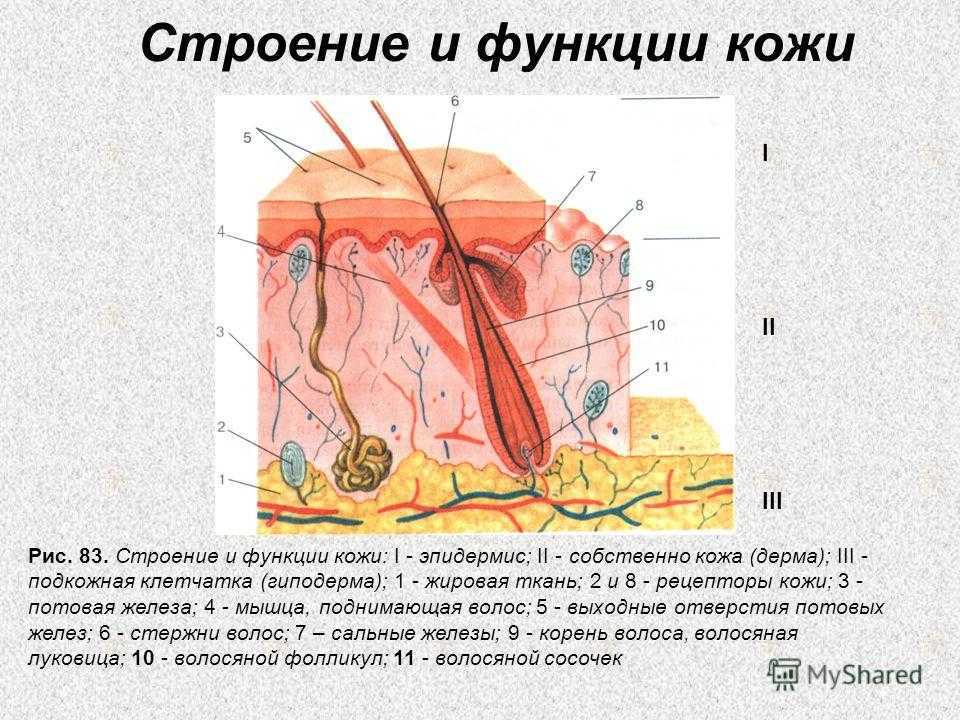
Таким образом, на основании полученных нами данных можно заключить, что роговой слой кожи служит барьером для прохождения через кожу окиси трития, при разрушении которого изотоп с большой скоростью поступает в организм крыс.
Выводы
1..Окись трития при поступлении через кожу равномерно распределяется в органах и тканях крыс.
2. С увеличением времени воздействия от 30 мин. до 12 часов содержание изотопа в организме животных возрастало и составляло 0,21—16,3% (интактная кожа), 1,71—89,75% (10-кратпое повреждение) и 40,96—85,3% (20-кратное повреждение) изотопа, нанесенного на кожу. Повреждение,кожных покровов повышает поступление окиси трития в организм крыс, а также изменяет динамику и скорость всасывания ее через кожу.
Л И _Т Е Р Д Т У Р А
В1 а п k I. Н., J. invest. Derm., 1952, v. 18, p. 433. — В u г r W., Dtsch. Arch, klin. Med., 1936, Bd 178, S. 550. — FredrikssonT., Acta derm. — venereol (Stockh.), 1962, v. 42, p. 405. — RothmanS., Physiology and Biochemistry of the Skin. Chicago, 1954. — T r e g e a r R. Т., J. invest. Derm., 1966, v. 46, p. 16. — Widdowson E. M., DickersonJ. W. В кн.: С. L. Comar, Bronner F. B. (Ed) Mineral Metabolism. New York, 1964, v. 2, Part A, Chapters 17, p. 2. — W i n s о г Т., В и г с h G. Е., Arch, intern. Med., 1944, v. 74, p. 428.
Chicago, 1954. — T r e g e a r R. Т., J. invest. Derm., 1966, v. 46, p. 16. — Widdowson E. M., DickersonJ. W. В кн.: С. L. Comar, Bronner F. B. (Ed) Mineral Metabolism. New York, 1964, v. 2, Part A, Chapters 17, p. 2. — W i n s о г Т., В и г с h G. Е., Arch, intern. Med., 1944, v. 74, p. 428.
Поступила 26/VII 1968 r.
FEATURES SPECIFIC TO PENETRATION OF TRITIUM OXIDE THROUGH THE INTACT AND DAMAGED SKIN
V. V. Khorobrykh
Tritium oxide can penetrate both through the intact and damaged skin. As thickness of the cutaneous layer decreases the extent of penetration of the isotope into the body augments: for /2-hour application 16.2S±0.6J% of the isotope applied is absorbed through the intact skin, 89.75±75% — through the /0-fold, damaged skin and 85.29±I.3S% — through the 20-fold damaged skin. The kinetics and rate of resorption of the substance the skin alters in destrustion of the cutaneous layer.
СОЦИАЛЬНАЯ ГИГИЕНА, ИСТОРИЯ ГИГИЕНЫ
И ОРГАНИЗАЦИЯ САНИТАРНОГО ДЕЛА — — —
4
УДК 614. 2(47)(0Э1)
2(47)(0Э1)
В. И. ЛЕНИН В БОРЬБЕ ЗА САНИТАРНОЕ ОЗДОРОВЛЕНИЕ СТРАНЫ В ПЕРВЫЕ ГОДЫ СОВЕТСКОЙ ВЛАСТИ
Канд. мед. наук М. Б. Мирский (Москва)
В создании и деятельности советского здравоохранения В. И. Ленину принадлежит выдающаяся роль. Не было ни одного сколько-нибудь важного вопроса охраны здоровья народа, в решении которого он не принимал бы участия. Великий вождь партии и народа повседневно интересовался делами медиков, направлял их усилия на главные, решающие участки борьбы с болезнями. Особое внимание уделял он борьбе за санитарное оздоровление страны. ‘ » %
Все о коже — Информация для пациентов
Анатомия и физиология кожи
Кожа – наш самый большой орган, составляющий 15% от общей массы тела. Она выполняет множество функций, прежде всего защищает организм от воздействия внешних факторов физической, химической и биологической природы, от потери воды, участвует в терморегуляции. Последние научные данные подтверждают, что кожа не только обладает собственной иммунной системой, но и сама является периферическим иммунном органом.
Структура кожи
Кожа состоит из 3 слоев: эпидермиса, дермы и подкожной жировой клетчатки (ПЖК) (рис. 1). Эпидермис – самый тонкий из них, представляет собой многослойный ороговевающий эпителий. Дерма – средний слой кожи. Главным образом состоит из фибрилл структурного белка коллагена. ПЖК содержит жировые клетки – адипоциты. Толщина этих слоев может значительно варьировать в зависимости от анатомического места расположения.
Рис.1. Структура кожи
Эпидермис
Рис. 2. Эпидермис
Эпидермис – постоянно слущивающийся эпителиальный слой кожи, в котором представлены в основном из 2 типа клеток – кератиноциты и дендритные клетки. В небольшом количестве в эпидермисе присутствуют меланоциты, клетки Лангерганса, клетки Меркеля, внутриэпидермальные Т-лимфоциты. Структурно эпидермис разделяется на 5 слоев: базальный, шиповатый, зернистый, блестящий и роговой, различающиеся положением и степенью дифференцировки кератиноцитов, основной клеточной популяции эпидермиса (рис. 2).
2).
Кератинизация. По мере дифференцировки кератиноцитов и продвижения от базального слоя до рогового происходит их кератинизация (ороговевание) – процесс, начинающийся с фазы синтеза кератина кератиноцитами и заканчивающийся их клеточной деградацией. Кератин служит строительным блоком для промежуточных филаментов. Пучки из этих филаментов, достигая цитоплазматический мембраны, формируют десмосомы, необходимые для образования прочных контактов между соседними клетками. Далее, по мере процесса эпителиальной дифференцировки, клетки эпидермиса вступают в фазу деградации. Ядра и цитоплазматические органеллы разрушаются и исчезают, обмен веществ прекращается, и наступаетапоптозклетки, когда она полностью кератинизируется (превращается в роговую чешуйку).
Базальный слой эпидермиса состоит из одного ряда митотически активных кератиноцитов, которые делятся в среднем каждые 24 часа и дают начало новым клеткам новым клеткам вышележащих эпидермальных слоев. Они активируются только в особых случаях, например при возникновении раны. Далее новая клетка, кератиноцит, выталкивается в шиповатый слой, в котором она проводит до 2 недель, постепенно приближаясь к гранулярному слою. Движение клетки до рогового слоя занимает еще 14 дней. Таким образом, время жизни кератиноцита составляет около 28 дней.
Далее новая клетка, кератиноцит, выталкивается в шиповатый слой, в котором она проводит до 2 недель, постепенно приближаясь к гранулярному слою. Движение клетки до рогового слоя занимает еще 14 дней. Таким образом, время жизни кератиноцита составляет около 28 дней.
Надо заметить, что не все клетки базального слоя делятся с такой скоростью, как кератиноциты. Эпидермальные стволовые клетки в нормальных условиях образуют долгоживущую популяцию с медленным циклом пролиферации.
Шиповатый слой эпидермиса состоит из 5-10 слоев кератиноцитов, различающихся формой, структурой и внутриклеточным содержимым, что определяется положением клетки. Так, ближе к базальному слою, клетки имеют полиэдрическую форму и круглое ядро, но по мере приближения клеток к гранулярному слою они становятся крупнее, приобретают более плоскую форму, в них появляются ламеллярные гранулы, в избытке содержащие различные гидролитические ферменты. Клетки интенсивно синтезируют кератиновые нити, которые, собираясь в промежуточные филаменты, остаются не связанными со стороны ядра, но участвуют в образовании множественных десмосом со стороны мембраны, формируя связи с соседними клетками. Присутствие большого количества десмосом придает этому слою колючий вид, за что он и получил название «шиповатый».
Присутствие большого количества десмосом придает этому слою колючий вид, за что он и получил название «шиповатый».
Зернистый слой эпидермиса составляют еще живые кератиноциты, отличающиеся своей уплощенной формой и большим количеством кератогиалиновых гранул. Последние отвечают за синтез и модификацию белков, участвующих в кератинизации. Гранулярный слой является самым кератогенным слоем эпидермиса. Кроме кератогиалиновых гранул кератиноциты этого слоя содержат в большом количестве лизосомальные гранулы. Их ферменты расщепляют клеточные органеллы в процессе перехода кератиноцита в фазу терминальной дифференцировки и последующего апоптоза. Толщина гранулярного слоя может варьировать, ее величина, пропорциональная толщине вышележащего рогового слоя, максимальна в коже ладоней и подошв стоп.
Блестящий слой эпидермиса (назван так за особый блеск при просмотре препаратов кожи на световом микроскопе) тонкий, состоит из плоских кератиноцитов, в которых полностью разрушены ядра и органеллы. Клетки наполнены элейдином – промежуточной формой кератина. Хорошо развит лишь на некоторых участках тела – на ладонях и подошвах.
Клетки наполнены элейдином – промежуточной формой кератина. Хорошо развит лишь на некоторых участках тела – на ладонях и подошвах.
Роговой слой эпидермиса представлен корнеоцитами (мертвыми, терминально-дифференцированными кератиноцитами) с высоким содержанием белка. Клетки окружены водонепроницаемым липидным матриксом, компоненты которого содержат соединения, необходимые для отшелушивания рогового слоя (рис. 3). Физические и биохимические свойства клеток в роговом слое различаются в зависимости от положения клетки внутри слоя, направляя процесс отшелушивания наружу. Например, клетки в средних слоях рогового слоя обладают более сильными водосвязывающими свойствами за счет высокой концентрации свободных аминокислот в их цитоплазме.
Рис. 3. Схематичное изображение рогового слоя с нижележащим зернистым слоем эпидермиса.
Регуляция пролиферации и дифференцировки кератиноцитов эпидермиса. Являясь непрерывно обновляющейся тканью, эпидермис содержит относительно постоянное число клеток и регулирует все взаимодействия и контакты между ними: адгезию между кератиноцитами, взаимодействие между кератиноцитами и мигрирующими клетками, адгезию с базальной мембраной и подлежащей дермой, процесс терминальной дифференцировки в корнеоциты. Основной механизм регуляции гомеостаза в эпидермисе поддерживается рядом сигнальных молекул – гормонами, факторами роста и цитокинами. Кроме этого, эпидермальный морфогенез и дифференцировка частично регулируются подлежащей дермой, которая играет критическую роль в поддержании постнатальной структуры и функции кожи.
Основной механизм регуляции гомеостаза в эпидермисе поддерживается рядом сигнальных молекул – гормонами, факторами роста и цитокинами. Кроме этого, эпидермальный морфогенез и дифференцировка частично регулируются подлежащей дермой, которая играет критическую роль в поддержании постнатальной структуры и функции кожи.
Дерма
Дерма представляет собой сложноорганизованную рыхлую соединительную ткань, состоящую из отдельных волокон, клеток, сети сосудов и нервных окончаний, а также эпидермальных выростов, окружающих волосяные фолликулы и сальные железы. Клеточные элементы дермы представлены фибробластами, макрофагами и тучными клетками. Лимфоциты, лейкоциты и другие клетки способны мигрировать в дерму в ответ на различные стимулы.
Дерма, составляя основной объем кожи, выполняет преимущественно трофическую и опорную функции, обеспечивая коже такие механические свойства, как пластичность, эластичность и прочность, необходимые ей для защиты внутренних органов тела от механических повреждений. Также дерма удерживает воду, участвует в терморегуляции и содержит механорецепторы. И, наконец, ее взаимодействие с эпидермисом поддерживает нормальное функционирование этих слоев кожи.
Также дерма удерживает воду, участвует в терморегуляции и содержит механорецепторы. И, наконец, ее взаимодействие с эпидермисом поддерживает нормальное функционирование этих слоев кожи.
В дерме нет такого направленного и структурированного процесса клеточной дифференцировки, как в эпидермисе, тем не менее в ней также прослеживается четкая структурная организация элементов в зависимости от глубины их залегания. И клетки, и внеклеточный матрикс дермы также подвергаются постоянному обновлению и ремоделированию.
Внеклеточный матрикс (ВКМ) дермы, или межклеточное вещество, в состав которого входят различные белки (главным образом коллаген, эластин), гликозаминогликаны, самым известным из которых является гиалуроновая кислота, и протеогликаны (фибронектин, ламинин, декорин, версикан, фибриллин). Все эти вещества секретируются фибробластами дермы. ВКМ представляет собой не беспорядочное скопление всех компонентов, а сложноорганизованную сеть, состав и архитектоника которой определяют такие биомеханические свойства кожи, как жесткость, растяжимость и упругость. К белкам ВКМ прикрепляются кератиноциты эпидермиса, которые тесно состыкованы друг с другом. Именно они и формируют плотный защитный слой кожи. Структура ВКМ также способна оказывать регулирующее влияние на погруженные в него клетки. Регуляция может быть как прямой, так и косвенной. В первом случае белки и гликозаминогликаны ВКМ непосредственно взаимодействуют с рецепторами клеток и инициируют в них специфические пути передачи сигнала. Косвенная регуляция осуществляется посредством действия цитокинов и ростовых факторов, удерживаемых в ячейках сети ВКМ и высвобождаемых в определенный момент для взаимодействия с рецепторами клеток. Структурная сеть ВКМ подвергается ремоделированию ферментами из семейства матриксных металлопротеиназ (ММР). В частности, ММР-1 и ММР-13 инициируют деградацию коллагенов I и III типов. Плотность сети ВКМ дермы неравномерна – в папиллярном слое она более рыхлая, в ретикулярном — значительно плотнее как за счет более близкого расположения волокон структурных белков, так и за счет увеличения диаметра этих волокон.
К белкам ВКМ прикрепляются кератиноциты эпидермиса, которые тесно состыкованы друг с другом. Именно они и формируют плотный защитный слой кожи. Структура ВКМ также способна оказывать регулирующее влияние на погруженные в него клетки. Регуляция может быть как прямой, так и косвенной. В первом случае белки и гликозаминогликаны ВКМ непосредственно взаимодействуют с рецепторами клеток и инициируют в них специфические пути передачи сигнала. Косвенная регуляция осуществляется посредством действия цитокинов и ростовых факторов, удерживаемых в ячейках сети ВКМ и высвобождаемых в определенный момент для взаимодействия с рецепторами клеток. Структурная сеть ВКМ подвергается ремоделированию ферментами из семейства матриксных металлопротеиназ (ММР). В частности, ММР-1 и ММР-13 инициируют деградацию коллагенов I и III типов. Плотность сети ВКМ дермы неравномерна – в папиллярном слое она более рыхлая, в ретикулярном — значительно плотнее как за счет более близкого расположения волокон структурных белков, так и за счет увеличения диаметра этих волокон.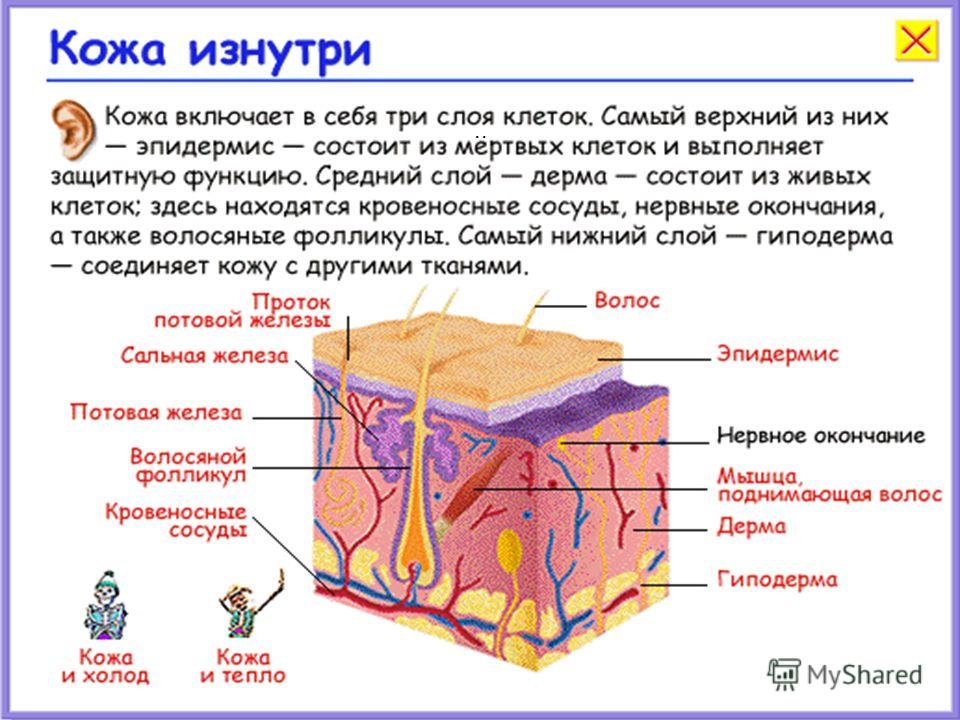
Коллаген – один из главных компонентов ВКМ дермы. Синтезируется фибробластами. Процесс его биосинтеза сложный и многоступенчатый, в результате которого фибробласт секретирует в экстрацеллюлярное пространство проколлаген, состоящий из трех полипептидных α-цепей, свернутых в одну тройную спираль. Затем мономеры проколлагена ферментивным путем собираются в протяженные фибриллярные структуры различного типа. Всего в коже не менее 15 типов коллагена, в дерме больше всего I, III и V типов этого белка: 88, 10 и 2% соответственно. Коллаген IV типа локализуется в зоне базальной мембраны, а коллаген VII типа, секретируемый кератиноцитами, играет роль адаптерного белка для закрепления фибрилл ВКМ на базальной мембране (рис. 4). Волокна структурных коллагенов I, III и V типов служат каркасом, к которому присоединяются другие белки ВКМ, в частности коллагены XII и XIV типов. Считается, что эти минорные коллагены, а также небольшие протеогликаны (декорин, фибромодулин и люмикан) регулируют формирование структурных коллагеновых волокон, их диаметр и плотность образуемой сети. Взаимодействие олигомерных и полимерных комплексов коллагена с другими белками, полисахаридами ВКМ, разнообразными факторами роста и цитокинами приводит к образованию особой сети, обладающей определенной биологической активностью, стабильностью и биофизическими характеристиками, важными для нормального функционирования кожи. В папиллярном слое дермы волокна коллагена располагаются рыхло и более свободно, тогда как ее ретикулярный слой содержит более крупные тяжи коллагеновых волокон.
Взаимодействие олигомерных и полимерных комплексов коллагена с другими белками, полисахаридами ВКМ, разнообразными факторами роста и цитокинами приводит к образованию особой сети, обладающей определенной биологической активностью, стабильностью и биофизическими характеристиками, важными для нормального функционирования кожи. В папиллярном слое дермы волокна коллагена располагаются рыхло и более свободно, тогда как ее ретикулярный слой содержит более крупные тяжи коллагеновых волокон.
Рис. 4. Схематичное представление слоев кожи и распределения коллагенов разных типов.
Коллаген постоянно обновляется, деградируя под действием протеолитических ферментов коллагеназ и замещаясь вновь синтезированными волокнами. Этот белок составляет 70% сухого веса кожи. Именно коллагеновые волокна «держат удар» при механическом воздействии на нее.
Эластин формирует еще одну сеть волокон в дерме, наделяя кожу такими качествами, как упругость и эластичность. По сравнению с коллагеном эластиновые волокна менее жесткие, они скручиваются вокруг коллагеновых волокон. Именно с эластиновыми волокнами связываются такие белки, как фибулины и фибриллины, с которыми, в свою очередь, связывается латентный TGF-β-связывающий белок (LTBP). Диссоциация этого комплекса приводит к высвобождению и к активации TGF-β, самого мощного из всех факторов роста. Он контролирует экспрессию, отложение и распределение коллагенов и других матриксных белков кожи. Таким образом, интактная сеть из волокон эластина служит депо для TGF-β.
Именно с эластиновыми волокнами связываются такие белки, как фибулины и фибриллины, с которыми, в свою очередь, связывается латентный TGF-β-связывающий белок (LTBP). Диссоциация этого комплекса приводит к высвобождению и к активации TGF-β, самого мощного из всех факторов роста. Он контролирует экспрессию, отложение и распределение коллагенов и других матриксных белков кожи. Таким образом, интактная сеть из волокон эластина служит депо для TGF-β.
Гиалуроновая кислота (ГК) представляет собой линейный полисахарид, состоящий из повторяющихся димеров D-глюкуроновой кислоты и N-ацетилглюкозамина. Количество димеров в полимере варьирует, что приводит к образованию молекул ГК разного молекулярного веса и длины — 1х105-107 Да (2-25 мкм), оказывающих, соответственно, различный биологический эффект.
ГК — высокогидрофильное вещество, влияющее на движение и распределение воды в матриксе дермы. Благодаря этому ее свойству наша кожа в норме и в молодости обладает высоким тургором и сопротивляемостью механическому давлению.
ГК с легкостью образует вторичные водородные связи и внутри одной молекулы, и между соседними молекулами. В первом случае они обеспечивают формирование относительно жестких спиральных структур. Во втором – происходит ассоциация с другими молекулами ГК и неспецифическое взаимодействие с клеточными мембранами, что приводит к образованию сети из полимеров полисахаридов с включенными в нее фибробластами. На длинную молекулу ГК, как на нить, «усаживаются» более короткие молекулы протеогликанов (версикана, люмикана, декорина и др.), формируя агрегаты огромных размеров. Протяженные во всех направлениях, они создают каркас, внося вклад в стабилизацию белковой сети ВКМ и фиксируя фибробласты в определенном окружении матрикса. В совокупности все эти свойства ГК наделяют матрикс определенными химическими характеристиками – вязкостью, плотностью «ячеек» и стабильностью. Однако сеть ВКМ является динамической структурой, зависящей от состояния организма. Например, в условиях воспаления агрегаты ГК с протеогликанами диссоциируют, а образование новых агрегатов между вновь синтезированными молекулами ГК (обновляющимися каждые 3 дня) и протеогликанами блокируется. Это приводит к изменению пространственной структуры матрикса: увеличивается размер его ячеек, меняется распределение всех волокон, структура становится более рыхлой, клетки меняют свою форму и функциональную активность. Все это сказывается на состоянии кожи, приводя к снижению ее тонуса.
Это приводит к изменению пространственной структуры матрикса: увеличивается размер его ячеек, меняется распределение всех волокон, структура становится более рыхлой, клетки меняют свою форму и функциональную активность. Все это сказывается на состоянии кожи, приводя к снижению ее тонуса.
Помимо регуляции водного баланса и стабилизации ВКМ, ГК выполняет важную регуляторную роль в поддержании эпидермального и дермального гомеостаза. ГК активно регулирует динамические процессы в эпидермисе, включая пролиферацию и дифференцировку кератиноцитов, окислительный стресс и воспалительный ответ, поддержание эпидермального барьера и заживление раны. В дерме ГК также регулирует активность фибробластов и синтез коллагена. Ремоделируя матрикс, ГК управляет функционированием клеток в матриксе, влияя на их доступность для различных факторов роста и изменяя их функциональную активности. От действия ГК зависит миграция клеток и иммунный ответ в ткани. Таким образом, изменения в распределении, организации, молекулярном весе и метаболизме ГК имеют значимые физиологические последствия.
Фибробласты представляют собой основной тип клеточных элементов дермы. Именно эти клетки отвечают за продукцию ГК, коллагена, эластина, фибронектина и многих других белков межклеточного матрикса, необходимых для формирования соединительной ткани. Фибробласты в различных слоях дермы различаются и морфологически, и функционально. От глубины их залегания в дерме зависит не только количество синтезируемого ими коллагена, но и соотношение типов этого коллагена, например I и III типов, а также синтез коллагеназы: фибробласты более глубоких слоев дермы производят меньшее ее количество. Вообще, фибробласты – очень пластичные клетки, способные менять свои функции и физиологический ответ и даже дифференцироваться в другой тип клеток в зависимости от полученного стимула. В роли последнего могут выступать и сигнальные молекулы, синтезированные соседними клетками, и перестройка окружающего ВКМ.
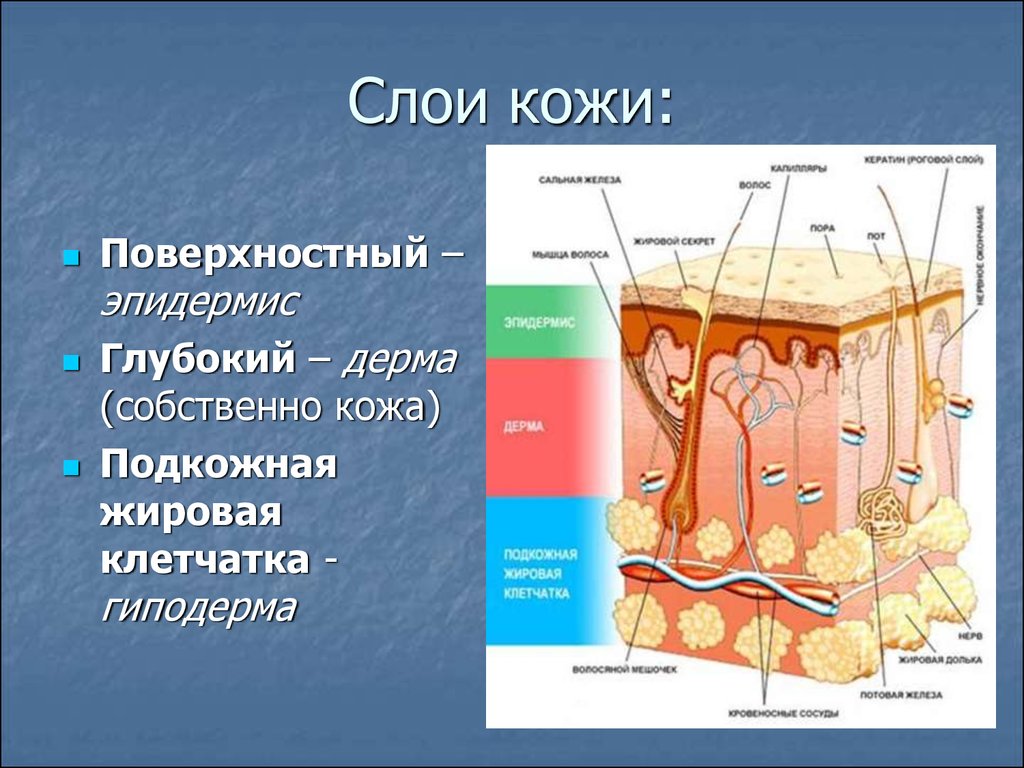
Подкожно-жировая клетчатка
Подкожно-жировая клетчатка, или гиподерма, — самый нижний слой кожи, располагается под дермой. Состоит из жировых долек, разделенных между собой соединительнотканными септами, содержащими коллаген и пронизанными крупными сосудами. Главными клетками жировых долек являются адипоциты, количество которых варьирует в различных областях тела. В настоящее время ПЖК рассматривают не только как энергетическое депо, но и как эндокринный орган, адипоциты которого участвуют в выработке ряда гормонов (лептина, адипонектина, резистина), цитокинов и медиаторов, оказывающих влияние на метаболизм, чувствительность к инсулину, функциональную активность репродуктивной и иммунной систем.
Состоит из жировых долек, разделенных между собой соединительнотканными септами, содержащими коллаген и пронизанными крупными сосудами. Главными клетками жировых долек являются адипоциты, количество которых варьирует в различных областях тела. В настоящее время ПЖК рассматривают не только как энергетическое депо, но и как эндокринный орган, адипоциты которого участвуют в выработке ряда гормонов (лептина, адипонектина, резистина), цитокинов и медиаторов, оказывающих влияние на метаболизм, чувствительность к инсулину, функциональную активность репродуктивной и иммунной систем.
Неповрежденная кожа – целостность, которую нельзя потерять
Обзор
. 2003 июнь; 49 (6): 27-8, 30, 33 прохода, продолжение.
R Гэри Сиббалд
1
, Карен Кэмпбелл, Патриция Куттс, Дуглас Куин
принадлежность
- 1 Медицинский факультет Университета Торонто.

PMID:
12874482
Бесплатная статья
Обзор
R Gary Sibbald et al.
Лечение стомы раны.
2003 июнь
Бесплатная статья
. 2003 июнь; 49 (6): 27-8, 30, 33 прохода, продолжение.
Авторы
R Гэри Сиббалд
1
, Карен Кэмпбелл, Патриция Куттс, Дуглас Куин
принадлежность
- 1 Медицинский факультет Университета Торонто.
PMID:
12874482
Абстрактный
Поддержание целостности кожи может быть сложной задачей, но это жизненно важно для общего состояния здоровья, особенно у пожилых пациентов. У этой популяции целостность кожи часто нарушается в результате недостаточной или чрезмерной гидратации, что может вызвать серьезные осложнения. Планы ухода должны включать профилактические меры, такие как использование барьерных и защитных средств, включая препараты оксида цинка, мази и кремы на основе вазелина и силикона, жидкообразующие продукты, липкие повязки, регуляторы жидкости, очищающие средства для кожи и увлажняющие средства. Командный подход, в который входят пациент, лица, осуществляющие уход, и медицинские работники, необходим для решения проблем пациентов, касающихся независимости/зависимости, использования вспомогательных систем и услуг, боли и контроля жидкостей организма. Роль поставщика медицинских услуг в этой команде должна подчеркивать непрерывность ухода, удовлетворенность пациентов и выбор продуктов — все это жизненно важно для защиты целостности кожи.
У этой популяции целостность кожи часто нарушается в результате недостаточной или чрезмерной гидратации, что может вызвать серьезные осложнения. Планы ухода должны включать профилактические меры, такие как использование барьерных и защитных средств, включая препараты оксида цинка, мази и кремы на основе вазелина и силикона, жидкообразующие продукты, липкие повязки, регуляторы жидкости, очищающие средства для кожи и увлажняющие средства. Командный подход, в который входят пациент, лица, осуществляющие уход, и медицинские работники, необходим для решения проблем пациентов, касающихся независимости/зависимости, использования вспомогательных систем и услуг, боли и контроля жидкостей организма. Роль поставщика медицинских услуг в этой команде должна подчеркивать непрерывность ухода, удовлетворенность пациентов и выбор продуктов — все это жизненно важно для защиты целостности кожи.
Похожие статьи
Обеспечение правильного использования средств по уходу за кожей на перистомальной коже.

Брюстер Л.
Брюстер Л.
Нурс Таймс. 2004 11–17 мая; 100 (19): 34–5.
Нурс Таймс. 2004.PMID: 15160502
Нарушения целостности кожи.
Мерфри РВ.
Мерфри РВ.
Нурс Клин Норт Ам. 2017 сен; 52 (3): 405-417. doi: 10.1016/j.cnur.2017.04.008.
Нурс Клин Норт Ам. 2017.PMID: 28779822
Обзор.
Уход или вред: изучение основных компонентов схем ухода за кожей.
Фогель Д.
Фогель Д.
Бр Дж Нурс. 2008 10–23 января; 17 (1): 24–30. doi: 10.12968/bjon.2008.17.1.28056.
Бр Дж Нурс. 2008.PMID: 18399393
Обзор.
Атопическая экзема: уход под руководством медсестры—2.
 Лечение.
Лечение.Лоутон С.
Лоутон С.
Дж Фам Здравоохранение. 2005;15(2):51-4.
Дж Фам Здравоохранение. 2005.PMID: 15945495
Обзор.
Никаких «если», «и» или «окурков»: спасите кожу и остановите боль.
Фаллер Н.А.
Фаллер Н.А.
Лечение стомы раны. 2006 декабрь; 52 (12): 10-2.
Лечение стомы раны. 2006.PMID: 17219696
Аннотация недоступна.
Посмотреть все похожие статьи
Цитируется
Наука о коже: измерение повреждений и оценка рисков.
Бернатчес С.Ф., Бичел Дж.
Бернатчес С.Ф. и соавт.
Adv Wound Care (Нью-Рошель). 2023 Апрель; 12 (4): 187-204. doi: 10.1089/ранение.2022.0021. Epub 2022 1 сентября.
Adv Wound Care (Нью-Рошель). 2023.
2023.PMID: 35
Пилотное исследование для изучения корреляции между маркерами воспаления и скоростью заживления ран у пациентов с диабетом.
Сонг И, Джо И, Сон Дж, Ким Р.
Сонг Ю и др.
Медицина (Каунас). 2022 6 марта; 58 (3): 390. doi: 10.3390/medicina58030390.
Медицина (Каунас). 2022.PMID: 35334566
Бесплатная статья ЧВК.Влияние пищеварительных ферментов на развитие дерматита, связанного с недержанием: повреждение внутренних тканей и нарушение кожного барьера, вызванное липидолитическими ферментами и протеазами в мацерированной коже крыс.
Мугита Ю., Минемацу Т., Накагами Г., Санада Х.
Мугита Ю и др.
Int Wound J. 2018 Aug;15(4):623-632. doi: 10.1111/iwj. 12906. Epub 2018 6 июня.
12906. Epub 2018 6 июня.
Международная рана J. 2018.PMID: 29877066
Бесплатная статья ЧВК.Вмешательства для профилактики и лечения дерматита, связанного с недержанием мочи, у взрослых.
Бекман Д., Ван Дамм Н., Шунховен Л., Ван Ланкер А., Коттнер Дж., Бил Х., Грей М., Вудворд С., Фейдер М., Ван ден Буше К., Ван Хекке А., Де Мейер Д., Верхаге С.
Бекман Д. и соавт.
Cochrane Database Syst Rev. 2016 Nov 10;11(11):CD011627. doi: 10.1002/14651858.CD011627.pub2.
Кокрановская система базы данных, ред. 2016 г.PMID: 27841440
Бесплатная статья ЧВК.Обзор.
Увлажняющие средства: скользкая дорога.
Сети А., Каур Т., Малхотра С.К., Гамбхир М.Л.
Сети А. и др.
Индийский Дж. Дерматол. 2016 май-июнь;61(3):279-87. дои: 10.4103/0019-5154.182427.
дои: 10.4103/0019-5154.182427.
Индийский Дж. Дерматол. 2016.PMID: 27293248
Бесплатная статья ЧВК.Обзор.
8
Бесплатная статья ЧВК.
Обзор.
Просмотреть все статьи «Цитируется по»
Типы публикаций
термины MeSH
- Скачать PDF
- Полный текст
Поделиться
Твиттер
Фейсбук
Электронная почта
LinkedIn- Процитировать это
- Разрешения
вещества
«ХИМИЧЕСКИЙ» АНАЛИЗ ИНТАКТНОЙ КОЖИ МЕТОДОМ ОТРАЖАТЕЛЬНОЙ СПЕКТРОФОТОМЕТРИИ | JAMA Dermatology
«ХИМИЧЕСКИЙ» АНАЛИЗ ИНТАКТНОЙ КОЖИ МЕТОДОМ ОТРАЖАТЕЛЬНОЙ СПЕКТРОФОТОМЕТРИИ | JAMA Дерматология | Сеть ДЖАМА
[Перейти к навигации]
Эта проблема
Артикул
Ноябрь 1951 г.
ДЖОЗЕФ В. ГОЛЬДЗИХЕР, MD ; ИРЕН С. РОБЕРТС, доктор философии. ; УИЛЬЯМ Б. РОУЛС, MD ; и другие
МАКС А. ГОЛЬДЗИЕР, MD
Принадлежности авторов
НЬЮ-ЙОРК
Из исследовательского отдела больницы Св. Клэр.
AMA Arch Derm Сифилол. 1951;64(5):533-548. doi: 10.1001 / archderm.1951.01570110003001
Полный текст
Абстрактный
НЕСКОЛЬКО ГОВОРЯТ, что одним из самых больших препятствий на пути прогресса в дерматологии является отсутствие практических количественных методов исследования кожи. Конечно, существует ряд хороших функциональных тестов: например, измерение потоотделения, содержания натрия в поте и секреции липидов возможно на количественной основе. 1 Эластичность кожи может быть изучена в определенных областях количественным способом, 2 , и такие тесты дают ценную информацию о некоторых функциях кожи.


 Лечение.
Лечение. 2023.
2023. 12906. Epub 2018 6 июня.
12906. Epub 2018 6 июня. дои: 10.4103/0019-5154.182427.
дои: 10.4103/0019-5154.182427.